今回は、専門的な内容の、医療用切削加工プラスチック素材の規制項目について説明します。
生体適合性とは、患者の生体組織や生理系とプラスチック素材との適合性を検証する評価基準です。
生体適合性を検証するということは、例えばプラスチック素材・部品・製品自体から、もしくはその分解物から有害な毒性生成物が発生するのか、アレルギー反応が誘発されるのかを調べることです。
生体適合性の代表的な規格である、ISO 10993とUSP(米国薬局方)は、プラスチック素材、部品、製品の生物学的安全性を検証する役割を果たしています。
また、FDA(アメリカ食品医薬品局)も、適合性に関する情報が得られるため、この種の情報をご要望いただくケースが多くあります。
医療用途にプラスチック素材を検討する場合は、その対象となる製品と用途に応じて、以下に述べるそれぞれの規格を参照し、素材選択と製品の安全性を評価するにあたっての貴重な補足情報となります。
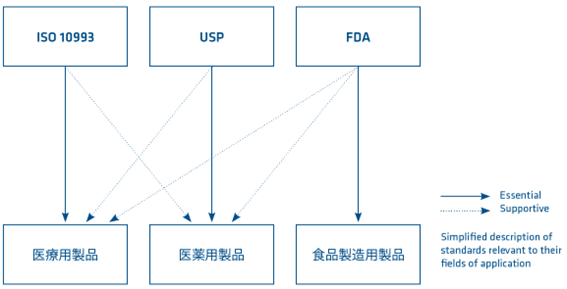
国際規格であるISO 10993は、医療用製品の製造業者と試験研究所に関連する規格ですが、現在では医療用製品に関するガイドラインとしても認められています。
当規格は、人体と直接的に接触する素材と生体の適合性の観点から、素材の安全性を評価することを目的としています。
生体適合性を検証する対象はもともと医療用製品そのものですが、医療用製品の原料・素材についても適合性の評価や判断をする際に用いることができます。
したがって、医療用製品にある素材を使用を検討する際に、素材の適格性を事前に評価することで、製品となったときのリスクを低減することができます。
ISO 10993-1に適合する医療用製品の生体毒性試験を合理的に行うためには、最初に製品をカテゴリ別に分類し、関連する医療用途で使用される素材のハザードレベルと要件の概要を定めます。
次に、使用する素材に関連する入手可能な毒物学的データを確認し、想定される生理学的影響を各プロセス別に段階的に分析・評価します。
以上の結果に基づき、最終評価に向けた毒物学的試験の実施や代替素材の検討の必要性について判断します。
2003年以降、ISO 10993規格には、生体毒性試験に関する検証とともに、毒性・アレルギー誘発性の疑われる素材や物質の特定を目的とする物理化学試験に関する検証項目が記載されるようになりました。
具体的には、ISO 10993規格を第1章から第20章までに分割し、サンプルの準備、試験の評価から、素材の化学的特性評価、さらには免疫毒性学的試験に至る内容を記載しています。
医療用製品の生理学的的確性について、ISO 10993に基づいて課せられる要件は、医療用製品の種類だけではなく、以下の要素によって決まります。
・使用箇所
(皮膚・粘膜・血液・組織)
・目的とする機能
(体表面との接触・体内組織との接触・インプラント用製品)
・使用期間
(24時間未満・30日未満・永久的)
USP(米国薬局方)では、医薬品に使用する包装材の評価を行っています。
USPは、全世界で製造され、米国内で一般に販売・消費・使用される製品の品質・衛生・同一性に関連する規格を編集し、その製品を確認する業務を行っています。
USPの規格は、特に医薬品とその製造技術を対象とする基本的な要件となります。
ただし、医療用製品については、USPは適格性に関する補足情報を提示するのみです。
さらに、USP試験による素材の生理学的リスク評価の内容は、ISO 10993による代替検査からも得ることができます。
そのため、特に近年では新しく開発される製品・技術について、USPの規格よりもISO 10993を優先して適用するようになりつつあります。
プラスチック製部品・製品の評価は、USPとを参照下さい。
USPでは、細胞毒性試験に関する説明が記載されていますが、ISO 10993-5とは細かい点においていくつか異なる箇所があります。
USPでは、製品をカテゴリーI〜 VIに分類し、カテゴリーVIに分類される製品には最も厳しい要件を要求し、広範囲に及ぶ総合的な試験を必要とします。
これは、いわゆる「生体内スクリーニング」と呼ばれるものを利用して、プラスチックの生体適合性に関する基本的な評価を目的とする、急性全身性毒性試験、炎症性試験を行います。
また、この試験には短期インプラント試験も含まれます。
FDA適合性は、食品との接触に関する素材の適合性評価以外にも、医療技術分野においても安全性を評価するための重要な情報を利用者に提供する手段としてよく利用されています。
しかしながら、FDA適合性は医療分野や医薬品分野における素材の使用についての法的拘束力を有する要件ではありません。
FDAは、食品と直接的・間接的に接触する素材の適合性評価を行い、CFR(連邦規則集)21でプラスチックの原料・添加剤・特性についてを規定しています。
諸要件を満たす素材はFDA適合素材とされ、その素材の配合斜方は、原料を変更しない限り、無期限に有効となります。
そのため、製品の製造業者がFDA認証を発行することができるのは、配合処方を把握していて、FDDA適合原料を使用していることを保証できる場合に限定されます。
医療分野で使用される原料のほとんどは、FDAの諸要件を満たしているので、お客様からの注文ごとに一気通貫したトレーサビリティに基づく認証証明書を発行できるのです。
医療用製品や医薬品の製造に、切削加工用プラスチック素材を使用していても、明確な定義の上では切削加工用プラスチック素材そのものは医療用製品や医薬品ではありません。
したがって、切削加工用プラスチック素材、そのものの生体適合性を評価するための標準的な要件は定められていません。
そこで、エンズィンガーでは、ISO 10993やUSPで定められている多種多様な生体適合性試験項目の中から、独自に設計した試験を実施しています。
この試験は、お客様が医療用最終製品や最終医薬品の製造・販売承認の諸手続を行う際に、可能な限りのサポートを行うことを目的とするものです。
生体との接触時間が24時間未満の医療用製品への使用を目的とする医療用グレード(MTグレード)では、
• 細胞毒性/増殖抑制試験 (ISO 10993-5)
• 溶血性試験 (ISO 10993-4)
• 化学分析/フィンガープリント試験 (ISO 10993-18)
• 生体毒性評価試験 (ISO 10993-1)
を組み合わせて実施し、段階的な生物学的安全性評価についてISO 10993-1の勧告に従っています。
細胞毒性(ISO 10993-5)と溶血性(ISO 10993-4)の体外試験を実施し、製品が血液や組織と接触しても十分な不活性さを保ち、所定の毒性評価試験をパスしていることを確認しています。
エンズィンガーでは、全ての医療用製品において標準試験・生物学的基礎試験としてみなされている細胞毒性/増殖抑制試験を実施し、材料の毒物学的評価の基盤としています。
細胞培養を利用すれば、素材から移行する毒性物質の有無について評価することができ、医療用製品や素材の生物学的安全性についての必要な情報が得られます。
また、特定条件下で血液と接触する可能性があるプラスチック素材には、溶血性試験を実施し、血液に対して素材が与える影響、素材から血液中に移行する可能性のある物質とその影響について評価します。
ISO 10993-18による化学分析を実施し、製品や表面汚染物質に含まれる可溶性有機物質や金属物質を特定し、毒物学的経験に基づく値と比較し、評価を行っています。
この分析方法により、素材による生体毒性の有無に関する知見を得ることができるばかりか、その原因を直接特定することができます。
さらに、最新の分析方法を利用すれば、検証限界の感度を高めることも可能となり、広範囲にわたる毒物学的研究よりも、評価における製品安全性を大幅に高めることができます。
さらにこの方法を利用することで、毒物学的試験結果に影響を与える可能性のある動物の免疫系による影響を回避することができます。
極めて微量の有害物質を溶媒にて抽出し、動物にアレルギー反応を引き起こす過程を分析することもできます。
弊社がお客様からのご注文に応じて発行している証明書には、関連原料を対象として実施した追加試験についても記載しています。この追加試験は、対象となる原料によって異なる可能性があります。
詳細につきましては、下記お問い合わせフォームよりお問合せください。
